Положительный эффект от аутогемотерапии известен врачам с начала ХX века. В 1905 году хирург Август Бир провел первый эксперимент по использованию аутогемотерапии для лечения переломов, создавая искусственные гематомы. В дальнейшем неоднократно врачи использовали аутогемотерапию что бы стимулировать защитные реакции больных инфекционными заболеваниями, фурункулезом, хроническими воспалительными заболеваниями.
Специалисты, применявшие аутогемотерапию, отмечали выраженную активизацию репаративных процессов: ускоренное заживление ран при восстановлении после травм и оперативных пособий, положительную динамику при гнойных процессах кожи и мягких тканей, ускоренное выздоровление при хронических воспалительных заболеваниях.
В известной работе выдающегося хирурга В.Ф. Войно-Ясенецкого «Очерки гнойной хирургии», подробно описано применение аутогемотерапии во время его работы в военном госпитале в 1904-1905 годах. Хорошие результаты и минимальная частота побочных эффектов на многие годы сделали аутогемотерапию и аутосеротерапию часто используемыми вспомогательными методами лечения рецидивирующих или вяло текущих гнойных процессов и длительно незаживающих ран вплоть до начала эры антибиотиков с широким антимикробным спектром. Однако после смерти профессора В.Ф. Войно-Ясенецкого данные методы лечения стали применяться гораздо реже.
В 1965 г. исследователь из Калифорнийского университета применял для стимуляции остеогенеза дефектов костей лицевого скелета обогащенную тромбоцитами плазму, как фактор, способствующий увеличению количества остеоиндуктивного морфогенетического белка («BMP — bones morphogenetic protein»). Он руководствовался работами коллег, где присутствовали данные о сильно выраженной остеогенной и хондрогенной активности субстанции, содержащихся в альфа-гранулах тромбоцитов. В дальнейшем данная методика нашла достаточно широкое применение в различных областях медицины: кардиологии под названием «тромбоцитарный концентрат» или «тромбоцитарный гель», в челюстнолицевой хирургии, где данная методика применялась для улучшения качества регенерата и ускорения имплантирования «анкеров».
В последние годы показана способность комплексной регуляции со стороны факторов роста нормализации структуры ткани и реакции на её повреждение, отмечена важная роль и эффективность использования факторов роста для восстановления поврежденных тканей. Поэтому, использование факторов роста представляется полезным в клинической практике, поскольку это способствует быстрому излечиванию с восстановлением полноценной ткани и обеспечивает быстрое и безопасное возвращение к неограниченной деятельности. Богатая тромбоцитами плазма (PRP) – простой, дешевый и минимально инвазивный способ получить естественную концентрацию аутологических факторов роста, поэтому в настоящее время широко проводятся эксперименты в различных областях медицины для выявления ее способности способствовать регенерации ткани с низким заживляющим потенциалом. Области применения: спортивная медицина, ортопедия, стоматология, дерматология, офтальмология, пластическая и челюстно-лицевая хирургия и т.д.
Наконец, было замечено, что хотя секреция фактора роста происходит, главным образом, в течение первого часа, тромбоциты остаются жизнеспособными в течение 7 дней и продолжают генерировать факторы роста, соответственно было сделано предположение, что одна единственная инъекция в поврежденную ткань могла бы быть достаточным лечением в большинстве клинических наблюдений. Исходя из этого, казалось бы, ясно, что данный перспективный инновационный подход следует применять как можно шире в клинической практике. Однако, существующие данные по использованию PRP в доклинических и клинических исследованиях спорны. Если литература о роли изолированных факторов роста при регенерации ткани широко представлена, то исследований на животных и клинических исследований, продемонстрирующих реальный потенциал PRP, способствующий восстановлению различных тканей, недостаточно.
Механизм действия обогащённой тромбоцитами аутоплазмы (ОТА)
Тромбоциты обычно известны своей ролью в гемостазе, но они также играют ключевую роль как промежуточное звено в процессе заживления поврежденной ткани за счёт способности выделять из своих α-гранул факторы роста. Тромбоциты содержат пулы хранения факторов роста включая полученный из тромбоцитов фактор роста (PDGF), трансформирующий фактор роста (TGF-b), тромбоцитный эпидермальный фактор роста (PDEGF), сосудистый фактор эндотелиального роста (VEGF), инсулиноподобный фактор роста 1 (IGF-1), фибробластический фактор роста (FGF) и эпидермальный фактор роста (EGF).
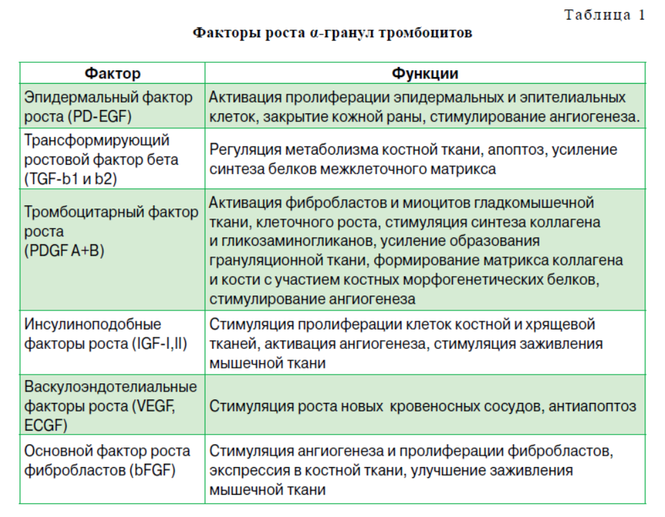
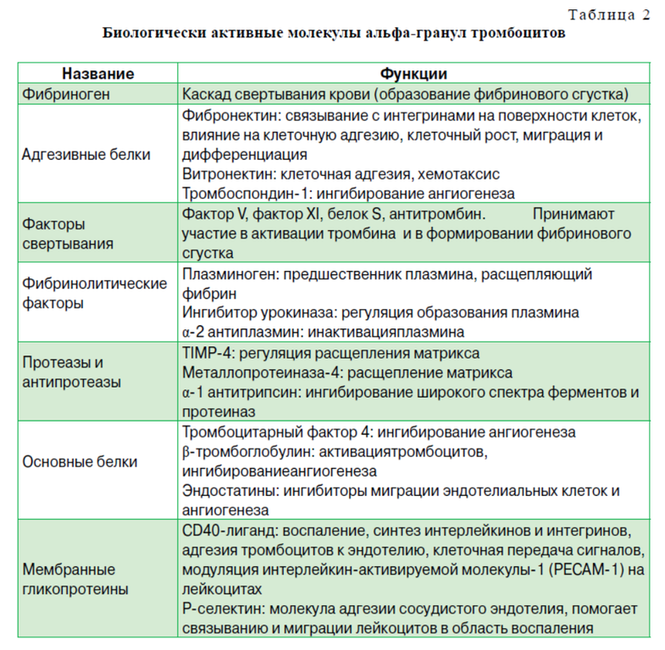
Альфа-гранулы являются также источником цитокинов, хемокинов и многих других белков, по-разному вовлеченных в стимулирование хемотаксиса, пролиферацию клеток и созревание, модуляцию подстрекательских молекул и привлечение лейкоцитов. Кроме того, тромбоциты хранят антибактериальные и фунгицидные белки, способные предотвращать инфекции, протеазы, такие как металлопротеаза-4 и факторы коагуляции. Помимо альфа-гранул, тромбоциты содержат плотные гранулы, которые хранят и выделяют после активации АДФ, ATФ, ионы кальция, гистамина, серотонина и допамина. Наконец, тромбоциты содержат лизосомные гранулы, которые могут секретировать кислотные гидролазы, катепсин D и E, эластазы и лизозим, и наиболее вероятно другие, пока еще недостаточно хорошо изученные молекулы, роль которых в процессе восстановления ткани нельзя недооценивать. Тот факт, что тромбоциты секретируют факторы роста и активные метаболиты, означает, что их прикладное использование может иметь положительное влияние в клинических ситуациях, требующих быстрого эффекта и регенерации ткани. ОТА является минимально инвазивным методом получения концентрата тромбоцитов и, соответственно, аутологических факторов роста и многих других биологически активных молекул, а их применение в форме тромбоцитного геля могло бы в дальнейшем стать преимуществом, которое в виде клейкой плёнки обеспечивало бы дальнейшую их секрецию в нужном месте.
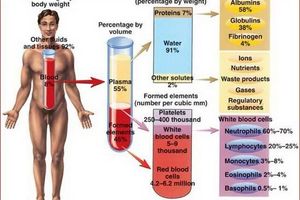
ОТА определяется как производное крови с более высокой концентрацией тромбоцитов по сравнению с исходной кровью, полученное дифференциальным центрифугированием аутологической цельной крови. Более детально элементы ОТА единообразно описаны в литературе не были. ОТА – это плазма, концентрация тромбоцитов в которой превышает нормальную в 3-3,5 раза. В норме концентрация тромбоцитов в среднем 220 000 клеток на мкл. Клинически эффективной считают концентрацию ОТА имеющей приблизительно 400% тромбоцитов от их уровня в периферической крови, т.е. она должна должна содержать ≥1 миллион тромбоцитов на микролитр. Однако, в литературе сообщается о большей вариабельности концентрации PRP, что клиническая эффективность PRP была продемонстрирована даже при меньших концентрациях.
Различные способы получения обогащенной плазмы, различные концентрации тромбоцитов, возможность присутствия лейкоцитов в тромбоцитарном концентрате и многие другие факторы, искажая результаты исследований, усложняют как доклинические исследования в этой области, так и клиническую оценку эффективности этого подхода для ускорения процессов репарации тканей.
Лизированая ОТА α-гранул тромбоцитов так же содержит семь основных факторов роста:
PDGF — тромбоцитарный фактор роста,
TGF – трансформирующий фактор роста (а и ß),
VEGF – фактор роста эндотелия сосудов,
EGF – фактор роста эпителия и т.д.
Данные эндогенные факторы роста находятся в определенном соотношении. Эндоцелюлярное количество детерминировано на генетическом уровне, сфера их воздействия рецепторы клеточных мембран стволовых клеток, где они проявляют высокую степень аффинности, вызывая их пролиферацию. Данные субстанции (PDGF – platelet derivate growth factor, VEGF – vessels endothelium growth factor, TGF – tissue growth factor» и др.) обладают олигопептидной структурой и принадлежат к группе «факторов роста», к которым также относятся эпидермальный фактор роста, инсулин и некоторые другие, отличительной чертой которых является повышенная степень аффинности и продолжительное время начального воздействия на рецепторы.
Сфера воздействия факторов роста в отличие от истинных мутагенов (ионизирующие излучение, канцерогены, недоокисленные радикальные группы и прочие), «факторы роста» не воздействуют на наследственный хромосомный аппарат клетки, а влияют на мембранные клеточные рецепторы I и II типа, что способствует ускорению роста и дифференцировки здоровых клетокпредшественников. Основным результатом исследований в этом разделе остеологии является обширное применение богатой тромбоцитами плазмой в лечении дефектов кости челюстно-лицевой области – «вживление имплантатов».
Тромбоцитарный фактор роста (PDGF-BB) является основным фактором (митогеном) для определенных групп клеток: фибробластов, клеток гладкой мускулатуры и других типов клеток. PDGF занимает основную из ведущих ролей в эмбриогенезе и регенерации поврежденных тканей. Выявлено и доказано его хемоаттрактантное и пролиферативное влияние на все клетки, принимающие участие в раневом процессе, отмечено выраженное влияние на клетки мезенхимального происхождения. Активированные тромбоциты являются главным источником PDFG-BB. Изначально PDGF обнаружили в сыворотке крови, но он отсутствует в свободной от клеток плазме крови. Синтез PDGF происходит не в тромбоцитах, его синтез осуществляется в мегакариоцитах и запасается в α-гранулах. При разрушении одного тромбоцита высвобождается примерно 1200 молекул PDGF. Общая концентрация всех изоформ PDGF в сыворотке крови поддерживается на постоянном уровне и составляет 50-60 нг/мл. Известно, что межклеточный коллагеновый матрикс связывает PDGF.
В организме клетки контактируют с плазмой и тканевой жидкостью, поэтому местная секреция PDGF играет значимую роль в регуляции их пролиферации. В процесс заживления раны вовлекаются клетки, находящиеся непосредственно в зоне повреждения. Активация и распад тромбоцитов являются стартом для процесса заживления ран. PDGF-BB индуцирует направленное перемещение (хемотаксис) основных клеточных типов, принимающих участие в процессе репарации: лейкоциты, макрофаги, фибробласты. В различных типах клеток при стимуляции PDGF повышается уровень экспрессии генов PDGF, а также происходит секреция PDGF-подобных медиаторов.
Тромбоциты содержат плотные гранулы с биологически активными молекулами, они не являются ростовыми факторами, но принимают участие в биохимических и обменных процессах организма, в том числе в воспалительных и регенеративных реакциях.

Использование ОТА в различных
областях медицины.
Обогащенную тромбоцитами аутоплазму получают путем центрифугирования цельной крови. Большинство специалистов использует инъекционный способ введения. Описаны случаи применения в виде аппликаций на раневую поверхность.
Травматология. Применения обогащенной тромбоцитами аутоплазмы, с целью оптимизации процессов репаративного остео- и хондрогенеза помогло улучшить результаты хирургического лечения больных с дефектами костной и хрящевой тканей. Авторы применили обогащенную аутоплазму при оскольчатых внутрисуставных переломах для адгезии свободно лежащих фрагментов хряща с субхондральной костью, что позволило избежать их удаления или фиксации имплантатами. Другие авторы использовали факторы роста у пациентов, подвергшихся артроскопичскому вмешательству на плечевом суставе в связи с повреждением его вращательной манжеты, а также при замещении дефекта манжеты мембраной из аутологичного насыщенного факторами роста фибрина. В этих исследованиях получены положительные результаты, заключающиеся в уменьшении интенсивности болевого синдрома и заживлении дефекта манжеты плеча через 6 месяцев. Опубликована работа в которой произведена оценка безопасности и результатов восстановления вращателя плеча с использованием факторов роста в рамках пилотного исследования на 14 пациентах и получил многообещающие устойчивые результаты по итогам 24-месячного наблюдения. Некоторые исследования посвящены изучению эффективности применения факторов роста при хронических повреждениях капсульно-связочного аппарата. Сообщено о хороших результатах, которые были достигнуты при лечении хронического тендиноза локтевого сустава с выраженным болевым синдромом. Полученные данные об эффективности факторов роста были подтверждены и в другой работе, где обнаружен, более значимый эффект от их применения по сравнению с инъекциями кортикостероидов при однолетнем наблюдении. В другом исследовании описаны предварительные результаты многократных инъекций факторов роста при лечении тендинопатии собственной связки надколенника и сделано заключение о безопасности и перспективности данной методики. В исследовании с участием 15 пациентов, страдающих от хронического синдрома «колена прыгуна», сообщено, что после того, как предыдущее консервативное или хирургическое лечение этой патологии не дало желательного результата, были применены многократные инъекции тромбоцитарных факторов роста (ТФР), в результате чего у большинства пациентов наступило заметное улучшение и они смогли восстановить свою прежнюю повседневную активность. Применение ТФР имеет большой потенциал при лечении повреждений боковых и крестообразных связок коленных суставов. Повреждения медиальной колатеральной связки (МКС) являются одними из наиболее распространенных среди активного населения и неадекватное лечение их повреждений может приводить к раннему развитию остеортроза у 13% пациентов. Поэтому в настоящее время существует потребность в методе, способным ускорить и сделать более качественным заживление этой связки. Опубликованы данные об улучшении показателей максимальной нагрузки на разрыв и окончательных показателей на растяжение после использования ТФР при повреждении МКС у кроликов. В другом исследовании показано увеличение прочности связки на 73% в течение 12 дней после начала их использования. Есть статьи в которых сообщают о многообещающих результатах использования ТФР для лечения связки, если оно применялось в соответствующих дозах вскоре после травмы.
Имеются работы, описывающие положительный эффект внутрисуставных инъекций аутоплазмы при сравнении с традиционными методами лечения остеоартрозов крупных суставов. Наиболее значимый эффект получен при лечении гонартроза по сравнению с другими локализациями остеоартрозов. Проведенное лечение позволило в короткие сроки ликвидировать болевой синдром, улучшить функцию суставов, значимо сократить длительность болевого синдрома и увеличить длительность ремиссии.
Применены инъекции тромбоцитарного концентрата при лечении остеоартрита коленного сустава, с использованием в качества контроля инъекций гиалуроновой кислоты, и показал лучшее обезболивание и физическое улучшение функции при использовании ТФР.
На основании результатов лечения с помощью внутрисуставных инъекций ТФР у 100 пациентов с гонартрозом, сделаны выводы о безопасности метода, уменьшении болевых ощущений и улучшении функциональности коленного сустава в течении как минимум 9 месяцев. В качестве побочных эффектов он указал на минимальное количество умеренно выраженных болевых реакций и местный тканевой отек, которые сохранялись не более 2 дней. Среди этих пациентов при наблюдении через 2, 6 и 12 месяцев, отмечалось статистически достоверное улучшение по всем оцениваемым параметрам. Тенденция к ухудшению наблюдалась при однолетнем и двухлетнем наблюдениях.
Более длительный эффект наблюдался у молодых людей с низким индексом массы тела и незначительной степенью повреждения хряща, тогда как в других группах пациентов наблюдались менее устойчивые результаты.
Комбустиология. Отдельного внимания заслуживает работа по использованию раневой повязки, состоящей из тонкой коллагеновой губки в сочетании с фактором PDGF-BB на процесс заживления ожоговых ран IIIA степени. Местное лечение ожоговых ран с применением биологической повязки на основе коллагена типа I с PDGF-BB приводит к сокращению сроков эпителизации до 5-7 суток и предупреждает развитие местных гнойно- некротических осложнений, что в 2-3 раза ускоряет процесс регенерации эпителия ожоговых ран IIIА степени и позволяет сократить время пребывания пациентов на стационарном лечении.
Спортивная медицина. Восстановление ткани при скелетно-мышечных травмах – часто является медленным, а в некоторых случаях и незавершённым процессом. Для спортсменов или профессиональных атлетов влияние скелетно-мышечных повреждений на качество жизни и работоспособность значительно больше, чем для обычных людей, поэтому быстрое восстановление полной работоспособности и возвращение к соревнованиям имеют главенствующее значение. Многочисленные исследования показали хорошие результаты лечения сухожилий различной локализации с использованием ТФР. Основным сдерживающим фактором использования ТФР у спортсменов до недавнего времени являлся недостаточный объем проведенных клинических исследований в этой группе пациентов.
В то же время, ТФР уже достаточно активно применяются для улучшения и ускорения восстановления капсульносвязочного аппарата, а большинство исследований в этой области уже охватывает и доклиническую и клиническую стадию их применения при лечении этого вида тканей. ТФР в настоящее время используются при лечении наиболее частых повреждений различных структур опорно-двигательного аппарата, а применение этого метода приобретает все больше сторонников.
Использованы ТФР при лечении повреждений суставного хряща у футболистов и при этом получены ускоренное и полное восстановление суставного хряща с быстрым возобновлением спортивной деятельности без признаков перенесённой травмы. В ряде других исследований при лечении хронических повреждений ахиллового сухожилия у спортсменов обнаружено более быстрое восстановление функций при минимальном количестве осложнений у спортсменов, при лечении которых применяли ТФР, что обуславливало сокращение общих сроков лечения. Многократные инъекции ТФР использовались при лечения острого частичного разрыва ахиллова сухожилия у спортсменов. При этом отмечено более быстрое восстановление ткани, зафиксированное с помощью МРТ и УЗИ, что позволило в кратчайшие сроки восстановить полную функциональность и обеспечить возвращение к полноценной спортивной деятельности. Показана эффективность ТФР при лечении повреждений мышц бедра у футболистов, причем эффективность оставалась одинаково высокой при повреждениях любой тяжести.
Стоматология. Гелевая форма аутоплазмы применялась в области лунок удаленных зубов. Обнаружено, что в тех лунках, которые заполнялись плазмой в виде геля, отмечался больший объем лучше организованной кости, причем в более короткие сроки и эпителизация раны также протекала гораздо быстрее.
Хирургия. Применение обогащенной аутоплазмы в лечении трофических язв голени венозной этиологии гарантирует широкий спектр местных и системных лечебных воздействий, позволяет улучшить результаты последующей аутодермопластики и в короткие сроки выполнить хирургическое лечение по ликвидации вено-венозных рефлюксов, это способствует сокращению сроков лечения, улучшению качества жизни и снижению стоимости лечения. Использование и применение обогащенной аутоплазмы технически не сложно, это позволяет применять данный метод для повсеместного использования.
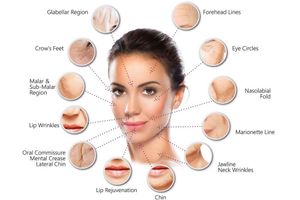
Дерматология. Встречаются работы по использованию обогащенной аутоплазмы в демратологии. Проведено исследование в котором участвовали 7 женщин, с диагнозом фотодерматоз в области латеральных углов глаз, после интенсивного облучения в солярии. Отмечен стойкий положительный клинический эффект в течение 9 месяцев. Считают, что интрадермальное введение аутогенной плазмы, богатой тромбоцитарными факторами роста является методом выбора при лечении фотодерматоза.
Заключение
Использование ТФР в виде различных форма в настоящее время прочно заняло свое место в клинической практике. Учитывая универсальный механизм их действия, они применяются в различных отраслях медицины и потенциал их использования еще далеко не исчерпан. К преимуществам методики можно отнести ее безопасность и низкую себестоимость. В то же время ее применение требует строгого соответствия протоколу использования, который при заболеваниях разных органов и систем может отличаться.
Наиболее значимым сдерживающим фактором для более широкого внедрения методики в повседневную работу врачей является недостаточное количество контролируемых рандомизированных исследований, посвященных оценки эффективности ТФР. Доступность метода и его эффективность открывают перспективы его более широкого использования в хирургии, в т.ч. гнойной, травматологии, комбустиологии, спортивной медицине, дерматокосметологии, при эндоскопических методах лечения.