Позитивний ефект від аутогемотерапії відомий лікарям з початку ХX століття. У 1905 році хірург серпня Бір провів перший експеримент з використання аутогемотерапії для лікування переломів, створюючи штучні гематоми. Надалі неодноразово лікарі використовували аутогемотерапию що б стимулювати захисні реакції хворих на інфекційні захворювання, фурункульоз, хронічними запальними захворюваннями.
Фахівці, котрі застосовували аутогемотерапию, відзначали виражену активізацію репаративних процесів: прискорене загоєння ран при відновленні після травм і оперативних посібників, позитивну динаміку при гнійних процесах шкіри і м'яких тканин, прискорене одужання при хронічних запальних захворюваннях.
У відомій праці видатного хірурга В.Ф. Войно-Ясенецького «Нариси гнійної хірургії», докладно описано застосування аутогемотерапии під час його роботи у військовому госпіталі в 1904-1905 роках. Хороші результати і мінімальна частота побічних ефектів на багато років зробили аутогемотерапию і аутосеротерапію часто використовуваними допоміжними методами лікування рецидивуючих або мляво поточних гнійних процесів і довго не загоюються ран аж до початку ери антибіотиків з широким антимікробним спектром. Однак після смерті професора В.Ф. Войно-Ясенецького дані методи лікування стали застосовуватися набагато рідше.
У 1965 р дослідник з Каліфорнійського університету застосовував для стимуляції остеогенезу дефектів кісток лицьового скелета збагачену тромбоцитами плазму, як фактор, що сприяє збільшенню кількості остеоіндуктівнимі морфогенетичного білка ( «BMP - bones morphogenetic protein»). Він керувався роботами колег, де були присутні дані про сильно вираженою остеогенной і хондрогенной активності субстанції, що містяться в альфа-гранулах тромбоцитів. Надалі дана методика знайшла досить широке застосування в різних областях медицини: кардіології під назвою «тромбоцитарний концентрат» або «тромбоцитарний гель», в челюстноліцевой хірургії, де дана методика застосовувалася для поліпшення якості регенерату і прискорення імплантування «анкерів».
В останні роки показана здатність комплексного регулювання з боку факторів росту нормалізації структури тканини і реакції на її пошкодження, відзначено важливу роль і ефективність використання факторів росту для відновлення пошкоджених тканин. Тому, використання факторів росту представляється корисним в клінічній практиці, оскільки це сприяє швидкому лікуванню з відновленням повноцінного тканини і забезпечує швидке і безпечне повернення до необмеженої діяльності. Багата тромбоцитами плазма (PRP) - простий, дешевий і мінімально інвазивний спосіб отримати природну концентрацію аутологічних чинників зростання, тому в даний час широко проводяться експерименти в різних областях медицини для виявлення її здатності сприяти регенерації тканини з низьким загоює потенціалом. Області застосування: спортивна медицина, ортопедія, стоматологія, дерматологія, офтальмологія, пластична і щелепно-лицьова хірургія і т.д.
Нарешті, було відмічено, що хоча секреція фактора росту відбувається, головним чином, протягом першої години, тромбоцити залишаються життєздатними протягом 7 днів і продовжують генерувати чинники зростання, відповідно було зроблено припущення, що одна єдина ін'єкція в пошкоджену тканину могла б бути достатнім лікуванням в більшості клінічних спостережень. Виходячи з цього, здавалося б, ясно, що даний перспективний інноваційний підхід слід застосовувати якомога ширше в клінічній практиці. Однак, існуючі дані по використанню PRP в доклінічних і клінічних дослідженнях спірні. Якщо література про роль ізольованих факторів росту при регенерації тканини широко представлена, то досліджень на тваринах і клінічних досліджень, продемонструє реальний потенціал PRP, що сприяє відновленню різних тканин, недостатньо.
Механізм дії збагаченої тромбоцитами аутоплазмой (ОТА)
Тромбоцити зазвичай відомі своєю роллю в гемостазі, але вони також грають ключову роль як проміжна ланка в процесі загоєння пошкодженої тканини за рахунок здатності виділяти зі своїх α-гранул чинники зростання. Тромбоцити містять пули зберігання чинників зростання включаючи отриманий з тромбоцитів фактор росту (PDGF), трансформуючий фактор росту (TGF-b), тромбоцитів епідермальний фактор росту (PDEGF), судинний фактор ендотеліального росту (VEGF), інсуліноподібний фактор росту 1 (IGF-1) , фібробластичних фактор росту (FGF) і епідермальний фактор росту (EGF).
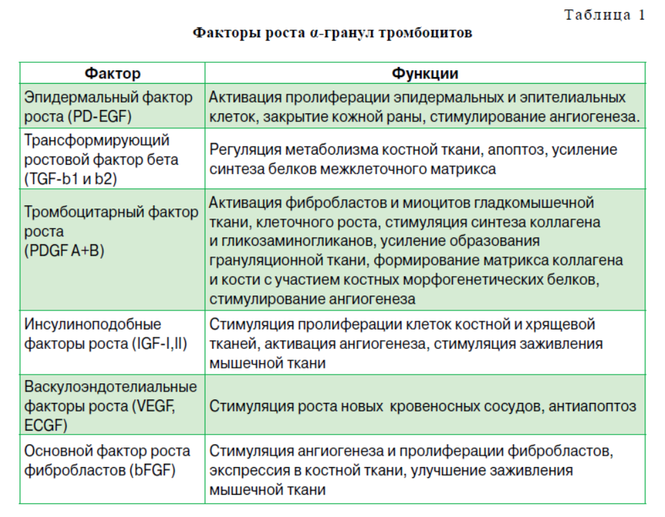
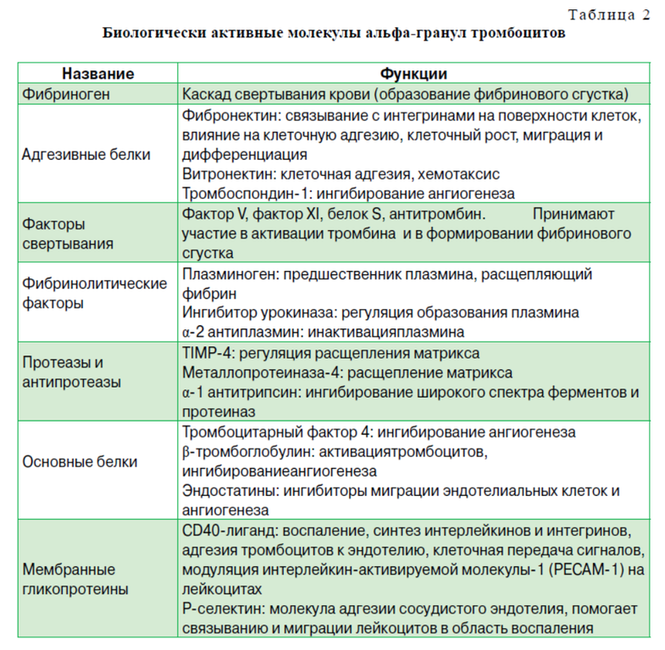
Альфа-гранули є також джерелом цитокінів, хемокінів і багатьох інших білків, по-різному залучених в стимулювання хемотаксису, проліферацію клітин і дозрівання, модуляцію підбурливих молекул і залучення лейкоцитів. Крім того, тромбоцити зберігають антибактеріальні і фунгіцидні білки, здатні запобігати інфекції, протеази, такі як МЕТАЛОПРОТЕАЗ-4 і фактори коагуляції. Крім альфа-гранул, тромбоцити містять щільні гранули, які зберігають і виділяють після активації АДФ, АТФ, іони кальцію, гістаміну, серотоніну і допаміну. Нарешті, тромбоцити містять лізосомні гранули, які можуть секретувати кислотні гідролази, катепсини D і E, еластази і лізозім, і найбільш імовірно інші, поки ще недостатньо добре вивчені молекули, роль яких в процесі відновлення тканини можна недооцінювати. Той факт, що тромбоцити секретують фактори росту і активні метаболіти, означає, що їх прикладне використання може мати позитивний вплив в клінічних ситуаціях, що вимагають швидкого ефекту і регенерації тканини. ОТА є мінімально інвазивним методом отримання концентрату тромбоцитів і, відповідно, аутологічних чинників зростання і багатьох інших біологічно активних молекул, а їх застосування в формі тромбоцитную гелю могло б надалі стати перевагою, яке у вигляді клейкої плівки забезпечувало б подальшу їх секрецію в потрібному місці.
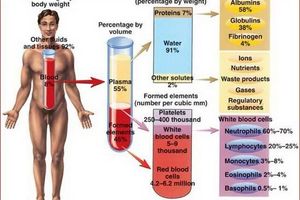
ОТА визначається як похідне крові з більш високою концентрацією тромбоцитів в порівнянні з вихідною кров'ю, отримане диференціальним центрифугуванням аутологічної цільної крові. Більш детально елементи ОТА одноманітно описані в літературі не були. ОТА - це плазма, концентрація тромбоцитів в якій перевищує нормальну в 3-3,5 рази. У нормі концентрація тромбоцитів у середньому 220 000 клітин на мкл. Клінічно ефективної вважають концентрацію ОТА має приблизно 400% тромбоцитів від їх рівня в периферичної крові, тобто вона повинна повинна містити ≥1 мільйон тромбоцитів на мікролітр. Однак, в літературі повідомляється про більшу варіабельності концентрації PRP, що клінічна ефективність PRP була продемонстрована навіть при менших концентраціях.
Різні способи отримання збагаченої плазми, різні концентрації тромбоцитів, можливість присутності лейкоцитів в тромбоцитарном концентраті і багато інших чинників, спотворюючи результати досліджень, ускладнюють як доклінічні дослідження в цій області, так і клінічну оцінку ефективності цього підходу для прискорення процесів репарації тканин.
Лізірованіе ОТА α-гранул тромбоцитів так само містить сім основних факторів зростання:
PDGF - тромбоцитарний фактор росту,
TGF - трансформуючий фактор росту (а і ß),
VEGF - фактор росту ендотелію судин,
EGF - фактор росту епітелію і т.д.
Дані ендогенні фактори росту знаходяться в певному співвідношенні. Ендоцелюлярное кількість детерміновано на генетичному рівні, сфера їх впливу рецептори клітинних мембран стовбурових клітин, де вони проявляють високу ступінь афінності, викликаючи їх проліферацію. Дані субстанції (PDGF - platelet derivate growth factor, VEGF - vessels endothelium growth factor, TGF - tissue growth factor »і ін.) Мають олігопептідной структурою і належать до групи« чинників зростання », до яких також відносяться епідермальний фактор росту, інсулін і деякі інші, відмінною рисою яких є підвищена ступінь афінності і тривалий час початкового впливу на рецептори.
Сфера впливу факторів росту на відміну від справжніх мутагенів (іонізуючі випромінювання, канцерогени, недоокислені радикальні групи і інші), «чинники зростання" не впливають на спадковий хромосомний апарат клітини, а впливають на мембранні клітинні рецептори I і II типу, що сприяє прискоренню зростання і диференціювання здорових клетокпредшественніков. Основним результатом досліджень в цьому розділі остеологии є широке застосування багатою тромбоцитами плазмою в лікуванні дефектів кістки щелепно-лицьової області - «вживлення імплантатів».
Тромбоцитарний фактор росту (PDGF-BB) є основним фактором (мітогеном) для певних груп клітин: фібробластів, клітин гладкої мускулатури і інших типів клітин. PDGF займає основну з провідних ролей в ембріогенезі і регенерації пошкоджених тканин. Виявлено і доведено його хемоаттрактантное і пролиферативное вплив на всі клітини, які беруть участь в ранового процесу, відзначено виражене вплив на клітини мезенхімального походження. Активовані тромбоцити є головним джерелом PDFG-BB. Спочатку PDGF виявили в сироватці крові, але він відсутній у вільному від клітин плазмі крові. Синтез PDGF відбувається не в тромбоцитах, його синтез здійснюється в мегакаріоцитів і запасається в α-гранулах. При руйнуванні одного тромбоцита вивільняється приблизно 1200 молекул PDGF. Загальна концентрація всіх ізоформ PDGF в сироватці крові підтримується на постійному рівні і складає 50-60 нг / мл. Відомо, що міжклітинний колагеновий матрикс пов'язує PDGF.
В організмі клітини контактують з плазмою і тканинної рідиною, тому місцева секреція PDGF відіграє значиму роль в регуляції їх проліферації. В процес загоєння рани залучаються клітини, що знаходяться безпосередньо в зоні пошкодження. Активація і розпад тромбоцитів є стартом для процесу загоєння ран. PDGF-BB індукує спрямоване переміщення (хемотаксис) основних клітинних типів, які беруть участь в процесі репарації: лейкоцити, макрофаги, фібробласти. У різних типах клітин при стимуляції PDGF підвищується рівень експресії генів PDGF, а також відбувається секреція PDGF-подібних медіаторів.
Тромбоцити містять щільні гранули з біологічно активними молекулами, вони не є ростовими факторами, але беруть участь у біохімічних і обмінних процесах організму, в тому числі в запальних і регенеративних реакціях.

Використання ОТА в різних
областях медицини.
Збагачену тромбоцитами аутоплазмой отримують шляхом центрифугування цільної крові. Більшість фахівців використовує ін'єкційний спосіб введення. Описані випадки застосування в вигляді аплікацій на ранову поверхню.
Травматологія. Застосування збагаченої тромбоцитами аутоплазмой, з метою оптимізації процесів репаративного остео- і хондрогенез допомогло поліпшити результати хірургічного лікування хворих з дефектами кісткової і хрящової тканин. Автори застосували збагачену аутоплазмой при осколкових внутрішньосуглобових переломах для адгезії вільно лежать фрагментів хряща з субхондральній кісткою, що дозволило уникнути їх видалення або фіксації імплантатами. Інші автори використовували фактори росту у пацієнтів, які зазнали артроскопічскому втручанню на плечовому суглобі в зв'язку з пошкодженням його обертальної манжети, а також при заміщенні дефекту манжети мембраною з аутологичного насиченого факторами зростання фібрину. У цих дослідженнях отримані позитивні результати, які полягають у зменшенні інтенсивності больового синдрому і загоєнні дефекту манжети плеча через 6 місяців. Опублікована робота в якій зроблено оцінку безпеки та результатів відновлення вращателя плеча з використанням факторів росту в рамках пілотного дослідження на 14 пацієнтах і отримав багатообіцяючі стійкі результати за підсумками 24-місячного спостереження. Деякі дослідження присвячені вивченню ефективності застосування факторів росту при хронічних пошкодженнях капсульно-зв'язкового апарату. Повідомлено про добрі результати, які були досягнуті при лікуванні хронічного Тендіноз ліктьового суглоба з вираженим больовим синдромом. Отримані дані про ефективність факторів росту були підтверджені і в іншій роботі, де виявлений, більш значимий ефект від їх застосування в порівнянні з ін'єкціями кортикостероїдів при однорічному спостереженні. В іншому дослідженні описані попередні результати багаторазових ін'єкцій чинників зростання при лікуванні тендінопатіі власної зв'язки надколінника і зроблено висновок про безпеку і перспективності даної методики. У дослідженні за участю 15 пацієнтів, які страждають від хронічного синдрому «коліна стрибуна», повідомлено, що після того, як попереднє консервативне або хірургічне лікування цієї патології не дало бажаного результату, були застосовані багаторазові ін'єкції тромбоцитарних факторів росту (ТФР), в результаті чого у більшості пацієнтів наступило помітне поліпшення і вони змогли відновити свою колишню повсякденну активність. Застосування ТФР має великий потенціал при лікуванні ушкоджень бічних і хрестоподібних зв'язок колінних суглобів. Пошкодження медіальної колатерального зв'язки (МКС) є одними з найбільш поширених серед активного населення і неадекватне лікування їх пошкоджень може приводити до раннього розвитку остеортроза у 13% пацієнтів. Тому в даний час існує потреба в методі, здатним прискорити і зробити більш якісним загоєння цієї зв'язки. Опубліковані дані про поліпшення показників максимального навантаження на розрив і остаточних показників на розтягнення після використання ТФР при пошкодженні МКС у кроликів. В іншому дослідженні показано збільшення міцності зв'язки на 73% протягом 12 днів після початку їх використання. Є статті в яких повідомляють про багатообіцяючі результати використання ТФР для лікування зв'язки, якщо воно застосовувалося в відповідних дозах незабаром після травми.
Є роботи, що описують позитивний ефект внутрішньосуглобових ін'єкцій аутоплазмой при порівнянні з традиційними методами лікування остеоартрозів великих суглобів. Найбільш значимий ефект отриманий при лікуванні гонартрозу в порівнянні з іншими локалізаціями остеоартрозів. Проведене лікування дозволило в короткі терміни ліквідувати больовий синдром, поліпшити функцію суглобів, значимо скоротити тривалість больового синдрому і збільшити тривалість ремісії.
Застосовані ін'єкції тромбоцитарного концентрату при лікуванні остеоартриту колінного суглоба, з використанням в якості контролю ін'єкцій гіалуронової кислоти, і показав кращий знеболювання і фізичне вдосконалення функції при використанні ТФР.
На підставі результатів лікування за допомогою внутрішньосуглобових ін'єкцій ТФР у 100 пацієнтів з гонартрозом, зроблені висновки про безпеку методу, зменшенні больових відчуттів і поліпшення функціональності колінного суглоба протягом як мінімум 9 місяців. В якості побічних ефектів він вказав на мінімальну кількість помірно виражених больових реакцій і місцевий тканинної набряк, які зберігалися не більше 2 днів. Серед цих пацієнтів при спостереженні через 2, 6 та 12 місяців, зазначалося статистично достовірне поліпшення по всіх оцінюваних параметрів. Тенденція до погіршення спостерігалася при однорічному і дворічному спостереженнях.
Більш тривалий ефект спостерігався у молодих людей з низьким індексом маси тіла і незначним ступенем пошкодження хряща, тоді як в інших групах пацієнтів спостерігалися менш стійкі результати.
Комбустіологія. На окрему увагу заслуговує робота по використанню рановий пов'язки, що складається з тонкої колагенової губки в поєднанні з фактором PDGF-BB на процес загоєння опікових ран IIIA ступеня. Місцеве лікування опікових ран із застосуванням біологічної пов'язки на основі колагену типу I з PDGF-BB призводить до скорочення термінів епітелізації до 5-7 діб і попереджає розвиток місцевих гнійно некротичних ускладнень, що в 2-3 рази прискорює процес регенерації епітелію опікових ран IIIА ступеня і дозволяє скоротити час перебування пацієнтів на стаціонарному лікуванні.
Спортивна медицина. Відновлення тканини при скелетно-м'язових травмах - часто є повільним, а в деяких випадках і незавершеним процесом. Для спортсменів або професійних атлетів вплив скелетно-м'язових пошкоджень на якість життя і працездатність значно більше, ніж для звичайних людей, тому швидке відновлення повної працездатності і повернення до змагань мають основного значення. Численні дослідження показали хороші результати лікування сухожиль різної локалізації з використанням ТФР. Основним стримуючим фактором використання ТФР у спортсменів до недавнього часу був недостатній обсяг проведених клінічних досліджень в цій групі пацієнтів.
У той же час, ТФР вже досить активно застосовуються для поліпшення і прискорення відновлення капсульносвязочного апарату, а більшість досліджень в цій області вже охоплює і доклінічну і клінічну стадію їх застосування при лікуванні цього виду тканин. ТФР в даний час використовуються при лікуванні найбільш частих ушкоджень різних структур опорно-рухового апарату, а застосування цього методу набуває все більше прихильників.
Використано ТФР при лікуванні ушкоджень суглобового хряща у футболістів і при цьому отримані прискорене і повне відновлення суглобового хряща з швидким відновленням спортивної діяльності без ознак перенесеної травми. У ряді інших досліджень при лікуванні хронічних ушкоджень ахіллового сухожилля у спортсменів виявлено більш швидке відновлення функцій при мінімальній кількості ускладнень у спортсменів, при лікуванні яких застосовували ТФР, що обумовлювало скорочення загальних термінів лікування. Багаторазові ін'єкції ТФР використовувалися при лікування гострого часткового розриву ахіллового сухожилля у спортсменів. При цьому відзначено більш швидке відновлення тканини, зафіксоване за допомогою МРТ та УЗД, що дозволило в найкоротші терміни відновити повну функціональність і забезпечити повернення до повноцінного спортивної діяльності. Показана ефективність ТФР при лікуванні ушкоджень м'язів стегна у футболістів, причому ефективність залишалася однаково високою при пошкодженнях будь-якої тяжкості.
Стоматологія. Гелева форма аутоплазмой застосовувалася в області лунок видалених зубів. Виявлено, що в тих лунках, які заповнювалися плазмою у вигляді гелю, відзначався більший обсяг краще організованою кістки, причому в більш короткі терміни і епітелізація рани також протікала набагато швидше.
Хірургія. Застосування збагаченої аутоплазмой в лікуванні трофічних виразок гомілки венозної етіології гарантує широкий спектр місцевих і системних лікувальних впливів, дозволяє поліпшити результати подальшої аутодермопластики і в короткі терміни виконати хірургічне лікування з ліквідації вено-венозних рефлюксів, це сприяє скороченню термінів лікування, поліпшення якості життя і зниження вартості лікування. Використання і застосування збагаченої аутоплазмой технічно не складно, це дозволяє застосовувати даний метод для повсюдного використання.
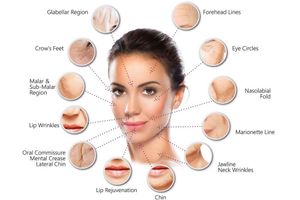
Дерматологія. Зустрічаються роботи по використанню збагаченої аутоплазмой в демратологіі. Проведено дослідження в якому брали участь 7 жінок, з діагнозом фотодерматоз в області латеральних кутів очей, після інтенсивного опромінення в солярії. Відзначено стійкий позитивний клінічний ефект протягом 9 місяців. Вважають, що інтрадермально введення аутогенного плазми, багатої тромбоцитарними факторами зростання є методом вибору при лікуванні фотодерматозу.
висновок
Використання ТФР у вигляді різних форма в даний час міцно зайняло своє місце в клінічній практиці. З огляду на універсальний механізм їх дії, вони застосовуються в різних галузях медицини і потенціал їх використання ще далеко не вичерпаний. До переваг методики можна віднести її безпеку і низьку собівартість. У той же час її застосування вимагає суворого відповідності протоколу використання, який при захворюваннях різних органів і систем може відрізнятися.
Найбільш значущим стримуючим фактором для більш широкого впровадження методики в повсякденну роботу лікарів є недостатня кількість контрольованих рандомізованих досліджень, присвячених оцінки ефективності ТФР. Доступність методу і його ефективність відкривають перспективи його більш широкого використання в хірургії, в т.ч. гнійної, травматології, комбустіології, спортивній медицині, дерматокосметології, при ендоскопічних методах лікування.