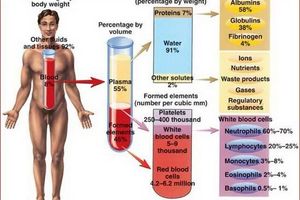
Известно, что использование собственной крови для лечения различных заболеваний началось в древние времена, т. е. с момента зарождения медицины. В настоящий момент использование богатой тромбоцитами плазмы (ОТП, РRР) является одним из успешных направлений тканевой инженерии и клеточной терапии в медицине. В эволюции терминологии встречается множество различных вариантов названий обогащенной тромбоцитами плазмы как конечного продукта. В клинической практике считается, что стимулирующий эффект обогащенной тромбоцитами плазмы возможен при концентрации тромбоцитов в ней не менее 1000000/ мкл. При повреждении тканей тромбоциты играют огромную роль в заживлении и регенерации тканей благодаря высвобождению факторов роста. Факторы роста – это естественные полипептиды, которые обладают широким биологического локального воздействия на многие кетки, посредством влияния на основные звенья регенераторного процесса: хемотаксис, клеточную пролиферацию, миграцию клеток, дифференцировку, реструктуризацию и ангиогене.
ОТП содержит такие факторы роста как: PDGF – тромбоцитарный фактор роста, TGF-β – трансформирующий фактор роста, EGF – фактор роста эпителия, VEGF – фактор роста эндотелия сосудов, но и адгезивные молекулы (фибрин, фибронектин и витронектин), цитокины. При центрифугировании, полученная плазма содержит белки, фибриноген, питательные вещества (глюкоза, липиды), гормоны, витамины, ферменты, промежуточные и конечные продукты обмена веществ, неорганические ионы, которые участвуют в каскаде процесса регенерации тканей [12, 20].
Учитывая, что ОТП является неотъемлемой частью собственной крови пациента, ее преимуществом является отсутствие риска парентеральной передачи ВИЧ инфекции, вирусного гепатита или возникновение иммунных реакций.
Существуют различные протоколы получения ОТП путем центрифугирования цельной крови в 1 или 2 этапа, после или без добавления антикоагулянта с получением различных конечных продуктов [12, 20].
В настоящее время существует простая классификация, основанная на характеристике молекул фибрина и содержания клеток (главным образом лейкоцитов), в которой выделяют 4 основных группы: 1) чистая обогащенная тромбоцитарная плазма (P-PRP); 2) обогащенная тромбоцитами и лейкоцитами плазма (L-PRP); 3) чистый обогащенный тромбоцитами фибрин (P-PRF); 4) обогащенный тромбоцитами и лейкоцитами фибрин (L-PRF). Эти 4 группы имеют различные способы получения, механизмы действия, соответствующие области применения [20].
Существуют мнения исследователей, что многие параметры получения ОТП, такие как количество оборотов и длительность центрифугирования, выбирались эмпирически и оценить их результаты объективно в сравнении с другими не представляется возможным [20].
Ряд авторов [17] определили, что концентрация тромбоцитов в ОТП коррелировала с количеством тромбоцитов в цельной крови донора. Однако какой-либо статистически значимой корреляции между количеством тромбоцитов в ОТП и в цельной крови донора выявлено не было. Было обнаружено значимое, но не имеющие клинического значения, влияние пола обследуемых на концентрацию тромбоцитов. Влияние возраста обнаружено не было.
При использовании ОТП у ряда исследователей возникла дискуссия о возможном влиянии ее клеточного состава. Так, некоторые авторы утверждают, что при инъекционном введении ОТП присутствие лейкоцитов может отрицательно влиять на клинические исходы из-за риска стимуляции воспалительного процесса [31]. Другие авторы оспаривают этот взгляд и говорят о выработке противоболевых медиаторов и действии лейкоцитов с естественной противовоспалительной способностью, как регулятора процесса заживления [31, 33].
Наибольшее применение ОТП нашла в стоматологической имплантологии [2]. Так, применение ОТП для костной пластики и профилактики атрофии челюстей перед дентальной имплантацией авторы добились формирования костной ткани в ранние сроки [4].С целью повышения качества и количества вновь формирующейся костной ткани при процедуре увеличения костного объема альвеолярной области верхней челюсти предложено использовать ОТП, в сочетании с трансплантацией аутологичной кости и различными остеозамещающими материалами [21, 29, 30].
Одним из основных механизмов регенерации является усиление кровоснабжения в тканях за счет стимуляции ангиогенеза при разрушении тромбоцитов и выделении ими факторов роста. В ОТП эти полипептидные факторы роста находятся в биологически предопределенных соотношениях.
В челюстно-лицевой реконструктивной медицине успешно используют гель из тромбоцитарный аутоплазмы, а также L-PRF мембраны, в том числе у детей с врожденными расщелинами верхней губы и неба [18, 24].
Плазма, обогащенная тромбоцитами нашла широкое применение в пародонтологии[18].
Описан инъекционный метод локальной стимуляции регенеративных процессов с применением ОТП, полученный после центрифугирования в пробирках Plasmolifting ТМ. В ходе исследования доказаны регенерационные свойства ОТП в виде снижения степени воспаления, уменьшения количества воспалительно-клеточных инфильтратов и воспалительных клеток в очаге воспаления тканей десны [11].
Многочисленные исследования, направленные на изучение эффективности использования ОТП в сердечно-сосудистой хирургии, доказали её положительное влияние у пациентов, после кардиохирургических операций. Реинфузия аутологичной обогащенной тромбоцитами плазмы улучшает гемостаз после искусственного кровообращения, может позволить снизить кровопотерю, проводить операцию без переливания гомологичной крови, а также купировать ряд гематологических нарушений [16, 19, 21].
Описано наблюдение тяжелой клинически проявляющейся фиброзной дисплазии лобно-глазничной области, по поводу которой проведена реконструкция с помощью ОТП [26]. Была достигнута длительная ремиссия симптомов и ранее формирование костной ткани. Сочетание введения ОТП с аллотрансплантацией или трансплантацией измельченной кости является безопасным, простым методом лечения.
Результаты клинических исследований в абдоминальной хирургии подтвердили эффективность клея с высоким содержанием фибрина при пластике по Лихтенштейну у пациентов с коагулопатиями на фоне заболеваний печени, а также длительно получавших антикоагулянты Использование фибриновых герметиков улучшает исходы хирургических вмешательств, ускоряет гемостаз, снижает кровопотери и число осложнений [5].
Полученные результаты экспериментального гистологического исследования структурно-функциональной организации при заживлении асептических ран мягких тканей на фоне применения ОТП показали, что данный метод лечения стимулирует процессы коллагенезации, эпидермизации, васкуляризации, происходит более быстрое формирование рубца [10].
В своей практике успешно применяют ОТП при хирургических и консервативных видах лечения воспалительных заболеваний суставов [23, 27].
На искусственно созданной модели остеоартроза коленного сустава у крыс применяли внутрисуставное введение тромбоцитарного геля [23], а также в работах по лечению травм мягких тканей опорно-двигательного аппарата (надрыв связок, мышц, сухожилий, тендопатий) использование ОТП в виде основного, а также дополнительного методов лечения (после хирургического вмешательства) подвергаются сомнению.
По мнению Л. Ю. Широковой с соавт. (2012) наблюдаются достоверные улучшения функционального состояния коленных суставов при локальном применение ОТП у пациентов гонартрозом с начальными проявлениями остеоартроза. При типичном гонартрозе II-III стадий, подтвержденных рентгенологически, ОТП оказывает кратковременное положительное влияние лишь в первый месяц наблюдений, тогда как при тяжелом гонартрозе, осложненном синовитом, лечение неэффективно.
Интраартикулярное введение ОТП в экспериментальной модели дефекта суставной поверхности коленного сустава на кроликах оказывает стимулирующее влияние на регенерацию гиалинового хряща, улучшая как качественные, так и количественные его характеристики [14].
Особый интерес приобретает вопрос использования конечных продуктов ОТП в эстетической пластической хирургии [25].
Имеются публикации об использовании ОТП в оториноларингологии для стимуляции регенерации барабанной перепонки при маленьких дефектах и после тимпанопластики [13]. Использование ОТП для герметизации пространства вокруг протеза при поршневой стапедопластике уменьшает риск развития сенсоневральной тугоухости по сравнению с использованием жировой клетчатки или свободным положением протеза. Вместе с тем уменьшается вероятность появления и интенсивность ушного шума после поршневой стапедопластики [7].
На основе проведенных исследований пациентов с хроническим гнойным средним отитом с применением ОТП при одновременном проведении санирующей операции и тимпанопластики в качестве опоры для неотимпанального трансплантата отмечалось более быстрое заживление послеоперационной полости, восстановление слуха [3], а также применение ОТП предупреждает возникновение перфораций, атрофических изменений барабанной перепонки и развитие спаечного процесса во вновь сформированной барабанной полости [9].
В результате экспериментального изучения функционального состояния звукопроводящей системы среднего уха и морфологических изменений в барабанной полости после заполнения ее ОТП у 6 свиней определена сохранность вентиляционной функции слуховой трубы, полная элиминация сгустка из барабанной полости, без образования рубцов и спаек [8].
Облитерация лобной пазухи с помощью трансплантата большеберцовой кости и введение ОТП после промывания и кюретажа пазухи может быть эффективным методом лечения хронического остеомиелита лобной пазухи [22].
Использование фибринового клея более эффективно, чем тампонада полости носа гемостатической губкой, а также применение химической и диатермокоагуляции у пациентов с носовым кровотечением [32].
Однако, при применении ОТП после эндоназальных эндоскопических хирургических вмешательств никакого благоприятного влияния не выявлено, исследование было прекращено досрочно [28].
Выполненные у 257 пациентов ринопластические и септопластические операции с использованием белково-тромбоцитарных свертков из обогащенной тромбоцитами плазмы показали их существенное преимущество над другими покровными материалами [1].
Местное применение ОТП после тонзиллэктомии позволяет существенно снизить вероятность послеоперационного кровотечения, уменьшает интенсивность болевых ощущений в глотке, а также снижает бактериальную обсемененность раневой поверхности в глотке, ускоряя процесс регенерации тканей [15].
Выводы: таким образом, ОТП является новой биотехнологией в клинической практике. Безопасность и эффективность ее использования широко освещены в литературе, но остается много нерешенных вопросов. На основании анализа научных публикаций новым шагом с биологической точки зрения необходима характеристика клеточного состава конечного продукта (наличие лейкоцитов, количества тромбоцитов и др.), которые могут влиять на процесс регенерации тканей. Возможность систематизация протоколов получения ОТП облегчит возможность использования в повседневной клинической практике.